哈工大生命科学中心何元政课题组联合陈政课题组、清华大学瑕瑜课题组在孤儿受体(GPR3)的结构研究中取得重要进展。研究成果以《油酸为GPR3的内源性配体》(Identification of oleic acid as an endogenous ligand of GPR3)为题发表在《细胞研究》(Cell Research)上。研究成果揭示了GPR3的天然配体、自激活机制和其在冷刺激诱导下的产热机理,为相关代谢类疾病治疗提供新思路。
GPR3作为A类G蛋白偶联受体中的孤儿受体,有较高的组成性活性,在神经系统和代谢方面发挥关键作用。在神经系统方面,GPR3可调节情绪,参与神经性疼痛和成瘾过程,且与阿尔茨海默症(老年痴呆)密切相关。在代谢方面,冷刺激下能诱导GPR3高表达并驱动脂肪产热等,因此具有治疗包括肥胖症和糖尿病等代谢类疾病的可能,然而其结构信息和内源性配体尚不明确。
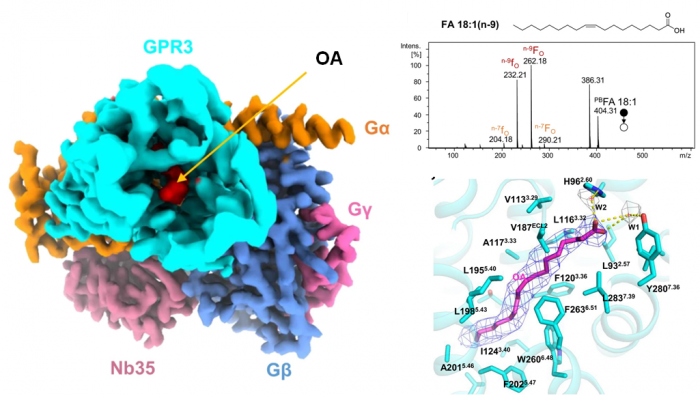
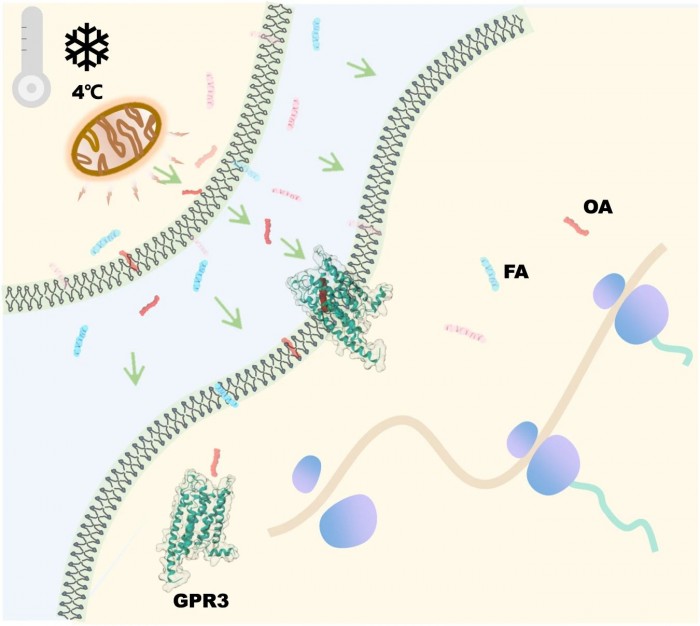
何元政课题组运用冷冻电子显微镜解析了GPR3与Gs蛋白的复合物结构,发现其分辨率达2.79埃,同时在结构分析中发现GPR3的配体结合口袋中有脂质类配体的电子云密度,通过质谱分析鉴定出该密度为油酸(oleic acid, OA)分子(图1)。此后的结构和功能分析表明,GPR3内的疏水通道连接了受体的胞外侧与细胞膜中部,使细胞膜内的脂肪酸易于与受体结合(图1)。同时,油酸、棕榈酸、月桂酸等游离脂肪酸(free fatty acid, FFA)可以结合并激活GPR3,而溶血磷脂酸则不能。进一步的动物实验表明,冷刺激可诱导小鼠体内OA的分泌,进而激活棕色脂肪组织中的Gs/cAMP/PKA信号通路,而Gpr3基因敲除小鼠在冷刺激时则对OA无反应。对此,研究人员针对GPR3的激活机制提出了“生而激活,遇冷则强”(born to be activated and cold to enhance)模型(图2),为理解GPR3激活和冷刺激下的产热机制提供基础。
图一. GPR3/Gs复合物冷冻电镜结构和配体鉴定
图二. GPR3“生而激活,遇冷则强”模型
哈工大何元政研究员、陈政研究员,清华大学瑕瑜教授为论文共同通讯作者。何元政课题组博士研究生熊杨杰、博士后徐珍媚,陈政课题组博士后李新志、王玉琴博士,瑕瑜课题组博士研究生赵婧为论文并列第一作者。何元政课题组王娜博士和博士研究生段亚宁、夏瑞雪、钱雨、梁佳乐,哈工大生命科学中心韩正滨高级工程师,日本东北大学井上飞鸟教授参与该课题研究工作。
该研究获国家自然科学基金和哈工大生命科学中心启动基金资助。
本文编辑:梁英爽 熊杨杰
本文审核:赵 婧