哈工大生命科学中心何元政课题组在鞘氨醇-1-磷酸(S1P)通过人鞘氨醇-1-磷酸转运蛋白(SPNS2)转运的结构基础方面取得新进展,揭示了SPNS2独特的S1P转运机制。12月20日,研究成果以《鞘氨醇-1-磷酸通过人鞘氨醇-1-磷酸转运蛋白(SPNS2)转运的结构基础》(Structural basis of Sphingosine-1-phosphate transport via human SPNS2)为题发表在《细胞研究》(Cell Research)上。该研究阐明了SPNS2介导的S1P转运,并有助于开发新型SPNS2抑制剂,为治疗自身免疫疾病提供新的靶点。
鞘氨醇-1-磷酸是细胞膜鞘脂的代谢物,作为脂质信号分子在免疫反应、血管发育和神经系统稳态等多种生理过程中发挥重要作用。S1P的适当空间梯度是S1P信号转导的关键,S1P空间梯度的建立是由S1P转运蛋白(包括SPNS2和MFSD2B)将S1P从细胞内侧运输到细胞外侧来实现的。尽管在建立S1P的空间梯度中起着关键作用,但目前对S1P的转运机制知之甚少。
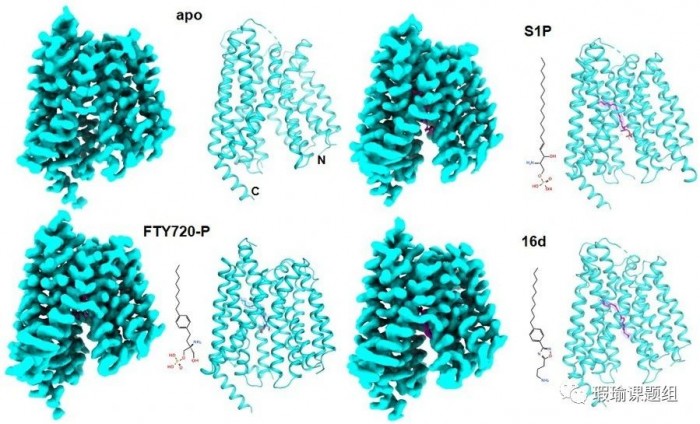
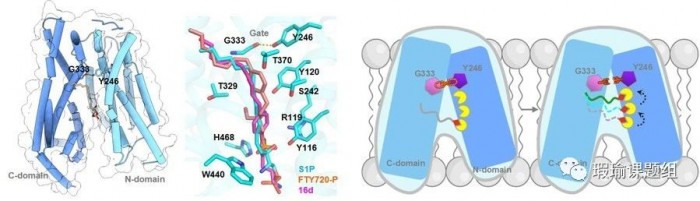
基于在S1P转运中发挥的重要作用和靶向SPNS2降低自身免疫性疾病方面的可能性,何元政课题组运用冷冻电镜技术解析了SPNS2的无配体结合状态、S1P结合状态、FTY720-P结合状态和抑制剂16d结合的多种状态结构(图1)。该研究开发出抗SPNS2的纳米抗体,以克服小尺寸膜蛋白在冷冻电镜结构解析中的困难,并开发出S1P转运检测方法来评估SPNS2的转运活性。该研究揭示了SPNS2门控区域中由Y246和G333形成的氢键是控制底物转运的关键因素(图2)。该研究还提出了用“阶梯”模型来阐述SPNS2的底物转运机制,底物的磷酸头基是运用SPNS2细胞内腔中一系列极性残基形成的“梯子”爬升到达了门控区域,进而进行脂质转运(图2)。此外,该研究还解析了最新研发的SPNS2抑制剂16d结合SPNS2的结构,并对其抑制机理进行了阐释。综上所述,通过解析SPNS2及其与小分子复合物的结构,该研究为理解S1P的转运机制提供了框架,并为设计靶向SPNS2的抑制剂提供了结构基础。
图1. SPNS2及其与小分子复合物的冷冻电镜结构
图2. SPNS2的底物转运机制
何元政课题组博士研究生段亚宁、新加坡国立大学医学院生物化学系阮龙(Long N.Nguyen)课题组博士研究生梁南希(Nancy C.P.Leong)、清华大学化学系瑕瑜课题组博士研究生赵婧为并列第一作者。何元政研究员、阮龙教授为共同通讯作者。何元政课题组硕士研究生张羽,博士研究生王娜,博士后徐珍媚,博士研究生夏瑞雪、马正雄、钱雨、尹晗、祝鑫焱,阮龙课题组博士研究生阮达特(Dat T.Nguyen)、哈和(Hoa T.T.Ha),瑕瑜教授参与该课题相关研究工作。
该研究获国家自然科学基金和哈工大生命科学中心启动基金等资助。
本文编辑:梁英爽,段亚宁
本文审核:赵 婧